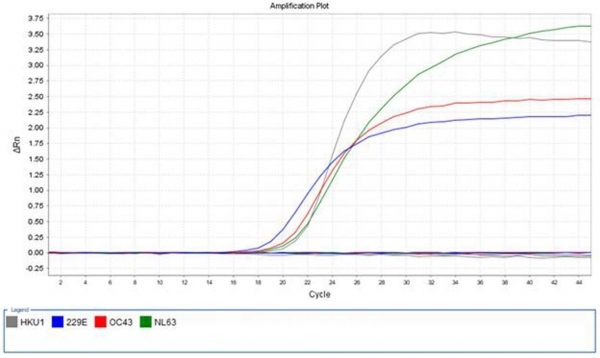
[비즈월드] 본 발명은 코로나바이러스의 4가지 아형인 HKU1, OC43, 229E 및 NL63을 동시에 검출하기 위한 프라이머 및 프로브, 이를 이용한 코로나바이러스의 검출방법에 관한 것이다. 구체적으로 본 발명의 일반적으로 사람에게 감염되는 코로나바이러스인 HCoV-229E, HCoV-OC43, HCoV-NL63 및 HCoV-HKU1를 동시에 검출할 수 있는 프라이머 및 프로브는 민감도가 우수하며, HCoV-229E, HCoV-OC43, HCoV-NL63 및 HCoV-HKU1를 특이적으로 검출할 수 있으므로, 본 발명의 프라이머 및 프로브 세트는 HCoV-229E, HCoV-OC43, HCoV-NL63 및 HCoV-HKU1의 검출 및 진단에 유용하게 사용될 수 있다.
지난 2019년 12월 31일 중국 보건당국이 후베이성 우한시에서 폐렴환자 27명이 집단 발생해 조사 중이라고 발표하면서 불거지기 시작한 우한 폐렴(신종 코로나바이러스 감염증)이 전 세계로 확산되고 있습니다.
우리나라의 경우 1월 8일 2019년 12월 13일부터 17일까지 중국 우한시를 방문했던 중국 국적 36세 여성이 유증상자로 분류돼 격리 치료 및 검사에 들어가 이후 2월 4일 오전 9시 현재 국내 확진 환자는 16명으로 늘어났습니다.
최초 발생국인 중국의 상황은 더 좋지 않습니다. 같은 시간 기준으로 중국에서만 2만438명이 확진자로 분류됐으며 사망자도 425명에 달했습니다. 중국 등을 포함해 총 27개 국가에서 총 2만619명의 확인자가 나왔고 사망자는 426명으로 늘어나는 등 전 세계가 이 전염병에 비상이 걸린 상태입니다.
이번 전염병의 원인이 된 코로나바이러스(coronavirus)는 코로나바이러스과(Coronaviridae)에 속하며 구형의 외막을 가지는 약 100 내지 120nm 크기의 단일가닥 양성 RNA 바이러스로, 가장 외각에 있는 스파이크(spike; S) 단백질, 헤마글루티닌-에스테라제(hemagglutinin-esterase; HE) 단백질, 막관통(transmembrane; M) 단백질, 작은 막(small membrane;E) 단백질, 뉴클레오캡시드(nucleocapsid; N) 단백질과 같은 5개의 구조 단백질로 이뤄져 있습니다.
코로나바이러스는 1937년 닭에서 처음 발견된 뒤 박쥐, 고양이, 소, 쥐, 개, 돼지, 조류 등의 동물을 거쳐 1965년에는 사람에게서도 발견됐습니다. 사람에게 감염되는 일반적인 사람 코로나바이러스로 HCoV-229E, HCoV-OC43, HCoV-NL63 및 HCoV-HKU1가 알려져 있습니다. 지금까지 코로나바이러스는 사람에게는 거의 감염되지 않고 주로 개, 돼지, 소 등의 동물에 감염되는 병원균으로 인식되어 왔으며, 사람에게 감염될 때에도 호흡기 증상을 유발하는 여러 바이러스 가운데 하나로서 단순한 감기를 유발하거나 어린이에게 위험성이 그리 높지 않은 설사 등의 장질환을 일으키는 경우가 있을 뿐이었습니다.
그러나 2003년 3월 중순에 처음으로 발생해 세계적으로 100명이 넘는 사망자와 3,000여 명의 환자를 발생시킨 중증급성호흡기증후군(SARS)과 2012년 9월에 사우디아라비아에서 처음으로 발생해 세계적으로 600명이 넘는 사망자와 1980여 명의 환자를 발생시킨 중동호흡기증후군(MERS)의 원인균이 신종(변종) 코로나바이러스인 것으로 알려지면서 점차 주목받기 시작했습니다.
사스(SARS) 또는 메르스(MERS) 바이러스는 일반적인 코로나바이러스와 달리, 사람에게 감염되면 생명을 위협할만큼 치명적이므로 이를 구별해 검출할 수 있는 방법의 개발이 필요했습니다.
이와 관련해 대한민국 특허등록 제100625325호에는 사스(SARS) 바이러스의 리더서열 또는 N 단백질을 코딩하는 염기서열 유래의 프로브 조성물과 프라이머 및 이를 이용한 코로나바이러스의 검출방법이 개시되어 있습니다.
이에 코젠바이오텍 발명자들은 코로나바이러스의 아형을 구별해 검출하기 위한 방법을 개발하던 중, 일반적으로 사람에게 감염되는 코로나바이러스인 HCoV-229E, HCoV-OC43, HCoV-NL63 및 HCoV-HKU1를 동시에 검출할 수 있는 프라이머 및 프로브를 제작하고, 상기 프라이머 및 프로브를 사용해 실시간 RT-PCR을 수행하면 우수한 민감도로 HCoV-229E, HCoV-OC43, HCoV-NL63 및 HCoV-HKU1를 동시에 특이적으로 검출할 수 있음을 확인하는데 성공했습니다.
해당 특허는 ㈜코젠바이오텍과 질병관리본부가 2017년 9월 22일 공동 출원(출원번호 제1020170122459호)하고 2018년 5월 8일 등록(등록번호 제101857685호)을 받은 '코로나바이러스의 아형을 동시에 검출하기 위한 프라이머 및 프로브, 이를 이용한 코로나바이러스의 검출방법'이라는 명칭입니다.
승인을 받은 진단시약은 코젠바이오텍에서 제조한 ‘PowerChekTM 2019-nCoV Real-time PCR Kit’로, ‘실시간 유전자 검출검사’ 방식입니다. 신종 코로나바이러스에만 존재하는 바이러스 특이 유전자 2개를 실시간으로 증폭해 검출해 확인하게 됩니다.
이 발명의 조성물을 포함하는 코로나바이러스의 아형을 동시에 검출할 수 있는 검출용 키트를 제공할 수 있게 된 것입니다.
이 발명은 검체를 주형으로 본 발명에 따른 프라이머 세트 및 프로브 세트를 사용해 실시간 중합효소 연쇄반응을 수행하는 것을 포함하는 코로나바이러스의 아형을 동시에 검출하는 방법을 제공합니다.
이 특허 기반의 발명에 따른 프라이머 및 프로브는 일반적으로 사람에게 감염되는 코로나바이러스인 HCoV-229E, HCoV-OC43, HCoV-NL63 및 HCoV-HKU1를 특이적으로 동시에 검출할 수 있고 민감도가 우수한 것으로 나타났습니다.
이에 질병관리본부는 1월 13일 WHO가 중국 우한시 집단폐렴의 원인을 신종 코로나바이러스로 확인함에 따라 중국이 학계(중국 푸단 대학교)를 통해 공개한 유전자염기서열을 입수해 초기 분석결과는 박쥐유래 사스 유사 코로나바이러스(Bat SARS-like coronavirus isolate bat-SL-CoVZC45, 상동성, 89.1%)와 가장 높은 상동성이 있음을 확인했으며 추가분석과 검사법 개발에 착수했다고 밝혔습니다.
이런 가운데 질병관리본부가 4일, 6시간 만에 신종 코로나바이러스 감염 여부를 확인할 수 있는 진단시약의 ‘긴급사용’을 승인키로 했다고 밝혔습니다.
기존 검사법보다 시간이 4분의 1로 단축되는 것입니다. 보건당국은 또 이 진단시약을 민간의료기관에서도 사용할 수 있도록 허가했습니다. 다만 검사 장비와 방호복 착용 등의 한계 때문에 당분간은 50여개 민간 의료기관에서만 가능할 것으로 예상되고 있습니다.
질병관리본부와 식품의약품안전처는 신종 코로나바이러스 진단시약 1개 제품의 ‘긴급사용 승인’을 결정했으며 질병관리본부가 지정한 의료기관에서 7일부터 환자 진단 검사에 사용될 예정이라고 4일 밝혔습니다.
‘긴급사용 승인’ 제도란 감염병 우려로 긴급히 진단시약이 필요하나 국내에 허가제품이 없는 경우 질병관리본부가 요청한 진단시약을 식약처장이 절차를 거쳐 승인해 한시적으로 사용할 수 있게 하는 제도입니다. 지카 바이러스가 확산될 때 처음 도입됐습니다.
그동안의 신종 코로나바이러스 검사법은 24시간 동안 2단계에 걸쳐 진행됐습니다. 그러나 이번에 승인받은 진단 검사(실시간 RT- PCR 검사법)는 6시간 안에 바이러스를 검출해 감염 여부를 확인할 수 있습니다.
질병관리본부의 승인을 받은 전국 약 50여개 의료기관에서 7일부터 순차적으로 검사 시행이 가능합니다.
감염 위험을 막기 위해 검체를 채취하는 의료진이 방호복을 갖춰 입어야 하고 PCR 검사 장비를 갖춘 의료기관에서만 검사가 가능하기 때문에 동네 의원에서는 진단이 어렵습니다. 검사를 받을 수 있는 민간 의료기관 명단은 7일 질병관리본부 홈페이지를 통해 공개될 계획입니다.
당국은 이번에 승인을 받은 진단시약은 1개 제품이지만 승인을 받지 못한 다른 제품도 미비점 개선 후 추가 평가·심의가 가능하다고 밝혔습니다. 단 신종 코로나바이러스 감염증의 유행이 종료되면 ‘긴급사용 승인’을 받은 진단시약은 사용이 중지될 수 있습니다.
정은경 질병관리본부 본부장은 “이번 ‘감염병 검사시약 긴급사용 승인’에 의한 진단검사 의료기관 확대는, 단시간 내에 진단법 실용화와 전국적 확산으로 국민을 보호한다는 의미가 있다”면서 “지역사회 단위의 확진자 모니터링 능력이 강화될 수 있을 것으로 기대한다”고 말했습니다.

